
El N,N-dimetiltriptamina (DMT) es un componente de la infusión de ayahuasca utilizada tradicionalmente con fines rituales y terapéuticos en varios países de América del Sur. En este estudio científico, se demuestra que la administración de DMT promueve la neurogénesis en adultos.
Presentación
“El compuesto de N,N-dimetiltriptamina encontrado en el té alucinógeno ayahuasca, regula la neurogénesis adulta in vitro e in vivo” (“N,N-dimethyltryptamine compound found in the hallucinogenic tea ayahuasca, regulates adult neurogenesis in vitro and in vivo”) es un artículo científico elaborado por los científicos Morales-García J.A., Calleja-Conde, J. A., Alonso-Gil, S., Sanz-SanCristobal, M., Riba, J. y Perez-Castillo, A., de la Universidad Complutense de Madrid (España), y publicado en el volumen 10 de la revista científica Traslational Psychiatry de Nature en septiembre de 2020, en el cual analizan y demuestran cómo el N.N-dimetiltriptamina (DMT) promueve la neurogénesis o formación de nuevas neuronas en adultos, tanto in vitro como in vivo.
El N,N-dimetiltriptamina (DMT) es un compuesto natural clasificado como un alucinógeno que induce modificaciones intensas en la percepción, la emoción y la cognición en humanos, el cual se encuentra en numerosas especies de plantas y preparaciones botánicas con fines rituales y terapéuticos, como la infusión conocida como té ayahuasca, consumida en varios países de América del Sur. No obstante, en muchos países, como Estados Unidos y el Reino Unido, es ilegal.
Asimismo, el DMT está presente, de forma natural, en varios tejidos animales, como el pulmón y el cerebro, y se considera un neurotransmisor endógeno con diferentes funciones fisiológicas, incluida la señalización neuronal y las acciones inmunológicas cerebrales/periféricas. También está presente en la sangre, la orina y el líquido cefalorraquídeo humanos. Además, alguna evidencia sugiere que la N,N-dimetiltriptamina puede secuestrarse y almacenarse en el sistema de vesículas del cerebro, y que el estrés ambiental aumenta sus niveles en el sistema nervioso central (SNC) de los mamíferos.
El N,N-dimetiltriptamina (DMT) se une y ejerce una actividad agonista sobre receptores de serotonina (5-HT), los cuales están involucrados en numerosas cascadas de señalización intracelular, con alta expresión en varias regiones del SNC. Algunos estudios han demostrado que el DMT también se une con baja afinidad a los receptores no serotoninérgicos, como el receptor sigma-1 (S1R) o σR-1, el cual está muy extendido en el SNC, principalmente en la corteza prefrontal, el hipocampo y el cuerpo estriado, y se ha asociado con varias funciones celulares, incluido el cerebro, como el transporte de lípidos, la regulación del metabolismo, la diferenciación celular, la señalización (en respuesta al estrés), la protección celular contra los agentes oxidantes, la mielinización y, más recientemente, la neurogénesis.
La neurogénesis es el proceso de generación de nuevas neuronas funcionales. En los mamíferos, este proceso ocurre mayoritariamente durante el período prenatal, siendo significativamente reducido en los adultos. En humanos, aunque recientemente se ha informado la presencia de neurogénesis adulta durante el envejecimiento, la mayoría de los estudios indican que no hay evidencia sustancial que la sustente. Los avances en el conocimiento de los factores que la regulan y su mecanismo de acción, podrían ayudarnos a investigar posibles nuevos instrumentos que permitan ampliar la limitada capacidad neurogénica endógena del cerebro adulto y, en consecuencia, abrir nuevos campos para el desarrollo de terapias eficaces en el tratamiento del daño cerebral y enfermedades neurodegenerativas como el Parkinson, el Alzheimer, el Hungtinton, etc. y el daño neural agudo, que se caracterizan por una pérdida gradual y selectiva de neuronas en las regiones afectadas del sistema nervioso, así como un deterioro en la proliferación de células progenitoras en los nichos neurogénicos.
La estimulación de poblaciones endógenas de células madre y progenitores neuronales, podría ser un enfoque prometedor para mejorar la funcionalidad de algunas de las regiones afectadas por patologías neurodegenerativas. De hecho, la estimulación de la neurogénesis ya ha sido propuesta como una nueva estrategia terapéutica para enfermedades psiquiátricas y neurológicas, y varios estudios han reportado que la eficacia clínica de los fármacos antidepresivos está frecuentemente ligada a su capacidad para inducir la neurogénesis.
Por su parte, la ayahuasca, también conocida como yagé, es una especie de té que resulta de la infusión de una mezcla de dos plantas del Amazonas: la liana o enredadera llamada ayahuasca planta (Banisteriopsis caapi (Spruce ex Griseb.) C.V.Morton 1931) y las hojas del arbusto chacruna (Psychotria viridis Ruiz & Pav., 1799), que contiene el principio activo N,N-dimetiltriptamina (DMT). La ayahuasca se utiliza desde hace milenios por los chamanes para tratar dolencias psicológicas.
Sin embargo, el DMT no se puede absorber por vía oral, ya que una enzima del sistema digestivo llamada monoamina oxidasa la descompone; pero la liana de la ayahuasca planta contiene un inhibidor de la monoamina oxidasa, con lo que, al tomar té de ayahuasca, la molécula de DMT puede pasar a la sangre y llegar al cerebro, donde se une a un receptor cerebral serotoninérgico y produce un efecto alucinógeno.

En este estudio publicado por los investigadores de la Universidad Complutense de Madrid, el receptor se cambió a un receptor de tipo sigma que no tiene ese efecto, lo que podría facilitar su futura administración a los pacientes. El objetivo principal de este trabajo, fue analizar el posible papel del N,N-dimetiltriptamina (DMT) en la neurogénesis adulta, así como dilucidar su mecanismo de acción. Así, se ha podido comprobar que tras cuatro años de experimentación in vitro e in vivo en ratones, el tratamiento con DMT producía neurogénesis y también el crecimiento de otras células neuronales como los astrocitos y los oligodendrocitos. Además, los animales tratados con DMT exhibían una mayor capacidad cognitiva, lo que podría abrir la puerta para el tratamiento de enfermedades neurodegenerativas.
En concreto, los resultados obtenidos, demuestran que el tratamiento con N,N-dimetiltriptamina (DMT) activa el nicho neurogénico subgranular que regula la proliferación de células madre neurales, la migración de neuroblastos y promueve la generación de nuevas neuronas en el hipocampo, lo que mejora la neurogénesis adulta y mejora el aprendizaje espacial y las tareas de memoria.
Método de trabajo
A continuación, se describe y explica el método de trabajo seguido por los científicos y autores de este trabajo.
Animales y ética
En este estudio utilizaron ratones macho adultos C57/BL6 (3 meses de edad) siguiendo los procedimientos y protocolos de experimentación animal específicamente aprobados por el “Comité de Ética de Experimentación Animal” del Instituto de Investigaciones Biomédicas (CSIC-UAM) y llevados a cabo de acuerdo con el Consejo de las Comunidades Europeas, directiva 2010/63/EEC y Reglamento Nacional, normativa RD1386/2018. Se tomaron las medidas adecuadas para minimizar el dolor o la incomodidad experimentada por los ratones.
Aislamiento de precursores adultos
Los SNC fueron aislados de la zona subgranular (SGZ) del hipocampo de ratones adultos. Utilizaron un número total de 24 animales divididos en cuatro grupos diferentes (seis animales/grupo). Para ello, el tejido fue diseccionado cuidadosamente, se disoció y luego se digirió durante 15 min a 37 °C.
Sembraron las células madre aisladas en placas de seis pocillos a una densidad de ~40 000 células por cm2 en DMEM/F12 (1:1) que contenía 10 ng/ml de factor de crecimiento epidérmico (EGF), 10 ng/ml de factor de crecimiento de fibroblastos (FGF) y medio N2.
Cultivo y tratamientos de neuroesferas
Después de 1 semana de cultivo en condiciones estándar, se formaron pequeñas esferas de crecimiento enriquecidas con progenitores neurales, conocidas como neuroesferas (NS). Teniendo todas las NS el mismo estadio y tamaño, los cultivos se trataron diariamente durante 7 días en condiciones proliferativas (en presencia de factores de crecimiento exógenos, EGF y FGF) con vehículo o DMT (1μM).
Algunos cultivos fueron pretratados individualmente con antagonistas de los diferentes receptores que se unen a la DMT: BD1063 (BD, sigma-1R), metiotepina (Met, 5-HT1A/2A), ritanserina (Rit, 5-HT2A) y WAY100635 (WAY, 5-HT1A). Ninguno de los fármacos probados afectó la viabilidad de las células cultivadas a esta dosis.
Medidas de crecimiento y proliferación
Después de 7 días de cultivo en presencia o no de compuestos, evaluaron el análisis de proliferación y crecimiento, y cuantificaron el número y tamaño de NS en diez pocillos, usando el software Nikon Digital Sight, SD-L1.
Cuantificaron, al menos, 50 neuroesferas por condición. A continuación, algunas de ellas se usaron para el análisis de inmunotransferencia, mientras que otras se sembraron en cubreobjetos y se cultivaron nuevamente en presencia de DMT (1μM) y/o DMT + antagonista (1μM) durante 24 h, en condiciones de diferenciación (medio que contenía suero bovino fetal al 1% y sin factores de crecimiento exógenos).
Luego, las NS se fijaron en paraformaldehído al 4% durante no más de 20 min y realizaron un análisis de inmunocitoquímica utilizando un anticuerpo específico para la proliferación.
La NS restante se cultivó para estudios de diferenciación.
Diferenciación de NS
Para determinar la capacidad del N,N-dimetiltriptamina (DMT) para estimular la formación de neuronas, astrocitos u oligodendrocitos, sembraron NS de cultivos de 7 días en placas de seis pocillos recubiertas con poli-l-lisina y/o en cubreobjetos, y las cultivaron en presencia de DMT (1μM) y/o DMT + antagonista (1μM) en condiciones de diferenciación (medio con 1% de suero bovino fetal y sin factores de crecimiento exógenos).
Una vez que se diferenciaron las neuroesferas (72 h), las que crecieron se usaron para inmunotransferencia y las que se encontraban en cubreobjetos, para análisis inmunocitoquímico.
Extracción de proteínas y análisis de transferencia Western
Las NS cultivadas en placas de seis pocillos recubiertas, se resuspendieron en tampón de lisis celular enfriado con hielo con un cóctel de inhibidores de proteasa, y se incubaron durante 15-30 minutos en hielo. Cargaron una cantidad total de 30µg de proteína extraída en un gel de SDS-PAGE y la transfirieron a membranas de nitrocelulosa. Las membranas se bloquearon en solución salina tamponada, se incubaron con anticuerpos primarios y secundarios, y se lavaron según procedimientos estándar.
Inmunocitoquímica
Después de 1 semana en cultivo, cuando se formaron las NS, algunas de ellas se inmunotiñeron usando un anticuerpo anti-receptor sigma-1 de conejo (Abcam ab53852), combinado con un anticuerpo anti-nestina de ratón (Abcam ab6142).
Al final del período de tratamiento, las NS cultivadas en cubreobjetos se fijaron de 15 a 20 minutos a temperatura ambiente en paraformaldehído al 4%, se permeabilizaron con Triton X-100 al 0,1% y se incubaron a 37°C durante 1 hora con el anticuerpo primario correspondiente. Luego, las células se lavaron con PBS y se incubaron con anticuerpos de cabra anti-conejo Alexa-488 y anti-ratón de cabra Alexa-647 durante 45 min a 37°C.
Para estudiar la proliferación, utilizaron un anticuerpo anti-ki67 de conejo (1:200, Abcam ab833). Para la diferenciación de NS en los diferentes tipos de células neurales, se utilizaron los siguientes anticuerpos: β-III-tubulina de conejo (1:400, clon TuJ-1; Abcam ab68193) y anti-MAP-2 de ratón (1:200, ratón; Sigma M4403) para neuronas; anti-GFAP de ratón (1/500, Sigma G3893) para células astrogliales, y anti-CNPasa de conejo (1:100, Cell Signaling #2986) como marcador de oligodendrocitos.
La tinción de los núcleos se realizó usando 4′, 6-diamidino-2-fenilindol (DAPI, 1/500).
Finalmente, obtuvieron las imágenes en un microscopio confocal espectral de barrido láser LSM710 (Zeiss).
Estudios neurogénicos in vivo
Dividieron los ratones alojados en una instalación para animales con ciclos de luz y oscuridad de 12 horas, según el tratamiento administrado:
(1). Ratones a corto plazo (n = 5 por grupo experimental), que recibieron una inyección intraperitoneal (i.p.) diaria durante 4 días consecutivos con DMT (2mg por kg de peso corporal) solo o en combinación con los antagonistas BD1063 (sigma- 1R), metiotepina (5-HT1A/2A), ritanserina (5-HT2A) y WAY100635 (5-HT1A). El día 4, inyectaron por vía intraperitoneal (i.p.) 5-bromo-2-desoxiuridina (BrdU; 50 mg/kg) a los ratones, los cuales sacrificaron el día siguiente.
(2). Ratones a largo plazo (n = 5 por grupo experimental), que recibieron cada dos días una inyección i.p. de DMT (2mg por kg de peso corporal) sola o en combinación con el antagonista correspondiente durante 21 días consecutivos. Para etiquetar las células en proliferación para estudios a largo plazo sobre supervivencia y diferenciación, inyectaron a los ratones BrdU (50 mg/kg) por vía intraperitoneal el día 1.
Todos los tratamientos intraperitoneales se administraron 1 h después de la inyección de clorgilina (1 mg/kg, ip).
Preparación de tejidos e inmunohistoquímica
Después del tratamiento, los animales, previamente anestesiados, fueron perfundidos transcardiacamente con solución de paraformaldehído al 4% y sus cerebros fueron procesados como se describió previamente.
Luego, incubaron las secciones de cerebro con conejo anti-receptor sigma 1 (Abcam ab53852) combinado con ratón anti-nestina (Abcam ab6142), monoclonal de ratón anti-BrdU (DAKO M0744) combinado con conejo anti-nestina (Abcam ab7659), conejo anti-NeuN (Millipore ABN78), o anticuerpos anti-doblecortina (DCX, Santa Cruz sc-8066), a 4°C durante la noche, lavados tres veces e incubados con anticuerpos secundarios AlexaFluor 488 de cabra anti-ratón y Alexa-647 de cabra anti-conejo durante 1 h a temperatura ambiente. Después de los enjuagues, las secciones se montaron con Vectashield.
Las imágenes las obtuvieron utilizando un microscopio confocal espectral de escaneo láser LSM 710 (Zeiss).
Analizaron cinco animales de cada grupo experimental.

Análisis de recuento de células
Para estimar el número total de células teñidas con un marcador en particular, utilizaron 5 ratones por grupo, a los que aplicaron un enfoque estereológico modificado en secciones coronales, del cerebro que contenían la SGZ.
Las imágenes fueron procesadas con el paquete de procesamiento de imágenes Fiji54.
Los resultados fueron expresados como el número total de células marcadas en el DG del hipocampo, multiplicando el número promedio de células marcadas/sección de estructura por el número total de secciones de 30μm de espesor que contenían el DG.
Estudios de comportamiento
Para los estudios de comportamiento, los ratones fueron inyectados como se mencionó anteriormente, con DMT (2mg/kg) solo o en combinación con ritanserina (0.2μg/animal), durante 21 días consecutivos. A los animales de control les inyectaron vehículo.
Realizaron el análisis de comportamiento durante 10 días y, finalmente, los animales se sacrificaron. En este caso, utilizaron doce animales por grupo experimental.
Análisis estadístico
Emplearon el paquete de software estadístico SPSS (versión 20.0) para Windows (Chicago, IL) para todos los análisis estadísticos, donde realizaron ANOVA unidireccional y ANOVA mixto de dos vías. Y después de confirmar la importancia de los hallazgos principales mediante ANOVA, aplicaron un nivel de significación de P < 0,05 a todos los análisis estadísticos post hoc restantes (prueba de Tukey).
Resultados del estudio sobre si la administración de N,N-dimetiltriptamina (DMT) promueve la neurogénesis en adultos
Y aquí se muestran e indican los resultados obtenidos por los científicos sobre el estudio de la administración de N,N-dimetiltriptamina (DMT) para promover la neurogénesis en adultos.
El N,N-dimetiltriptamina (DMT) controla la potencia de los progenitores neuronales in vitro a través del receptor S1R
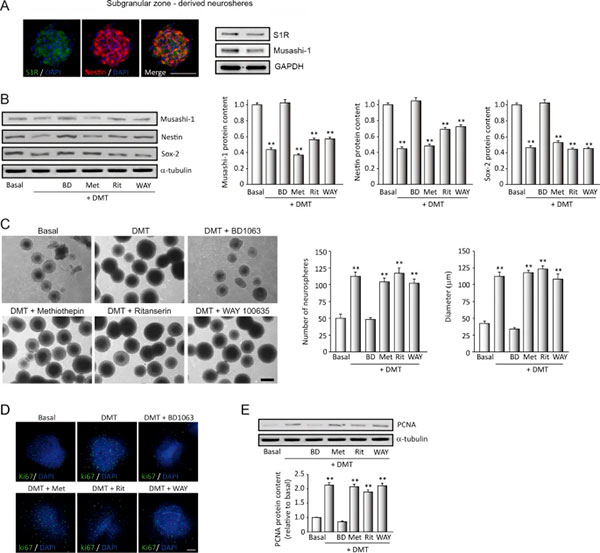
En primer lugar, analizaron si el receptor sigma-1 (S1R) se expresaba en células del NSC aisladas de la zona subgranular de la circunvolución dentada del hipocampo. La Figura 1a muestra la expresión de S1R en neuroesferas en el estado basal determinado por inmunocitoquímica y análisis de transferencia Western. En verde está marcada la expresión de S1R en células madre neurales (marcadas en rojo).
Para analizar la “troncalidad” (diferenciación) de las neuroesferas cultivadas, determinaron la expresión de marcadores de potencialidad de este estado. Luego, realizaron un análisis de WB después del tratamiento de estos cultivos durante 7 días en condiciones proliferativas con DMT solo o en combinación con los diferentes antagonistas. Los resultados (Fig. 1b) muestran reducciones significativas en los niveles de proteína de musashi-1, nestina y SOX-2 en las neuroesferas derivadas de SGZ después del tratamiento con DMT, lo que sugiere una pérdida de troncalidad en las NSC en las NS cultivadas.
Cuando estos cultivos se pretrataron con BD1063, un antagonista específico de S1R, este efecto se revirtió y los niveles del marcador de troncalidad fueron similares a los observados en condiciones basales. Por el contrario, la expresión de marcadores de troncalidad en aquellos cultivos tratados con DMT junto con el antagonista mixto del receptor de serotonina 5-HT1A/2A metiotepina, el antagonista selectivo del receptor 5-HT2A ritanserina o el antagonista selectivo del receptor 5-HT1A WAY100635, disminuyó significativamente, así como ocurrió en cultivos tratados con DMT. Estos resultados sugieren que el N,N-dimetiltriptamina (DMT) promueve una pérdida de «troncalidad» o estado indiferenciado de las neuroesferas a través del S1R.
El DMT promueve la proliferación in vitro de NSC
También utilizaron otros cultivos de NS para estudiar la proliferación, donde se evaluó el número y el diámetro de las neuroesferas, tal y como puede verse en las micrografías de contraste de fase de la Figura 1c, que muestran la formación y la cuantificación del número y diámetro de NS. Con esto, vieron que el DMT aumentó notablemente el número y el tamaño de las neuroesferas después de 7 días de tratamiento, lo que indica que el DMT promueve la proliferación de progenitores neurales derivados del hipocampo adulto.
El efecto proliferativo de DMT se bloqueó cuando los cultivos se trataron con BD1063, mostrando una disminución significativa en el número y tamaño de las neuroesferas, similar a las condiciones basales. Además, observaron diferencias significativas en el número y tamaño de las neuroesferas cuando los cultivos se trataron con DMT combinado con metiotepina, ritanserina o WAY100635.
A continuación, analizaron los cambios en dos marcadores bien conocidos para la proliferación, ki67 y el antígeno nuclear de células en proliferación (PCNA), lo cual se representa en las Figuras 1d y 1e. El análisis inmunocitoquímico fluorescente de la expresión de ki67 (Fig. 1d) mostró un aumento en el número de células ki67+ en el NS después del tratamiento con DMT, lo que sugiere un efecto directo del DMT en la capacidad de proliferación de las NSC. Este efecto se revirtió claramente cuando los cultivos también se incubaron con el antagonista BD1063. Asimismo, obtuvieron resultados similares mediante el análisis de transferencia Western y la posterior cuantificación de PCNA (Fig. 1e). No observaron diferencias significativas en la expresión de ki67 y PCNA cuando los cultivos se preincubaron con otros antagonistas de DMT. Estos resultados indican que el N,N-dimetiltriptamina (DMT) estimula in vitro, a través del S1R, la proliferación de progenitores neurales del nicho neurogénico adulto del hipocampo.
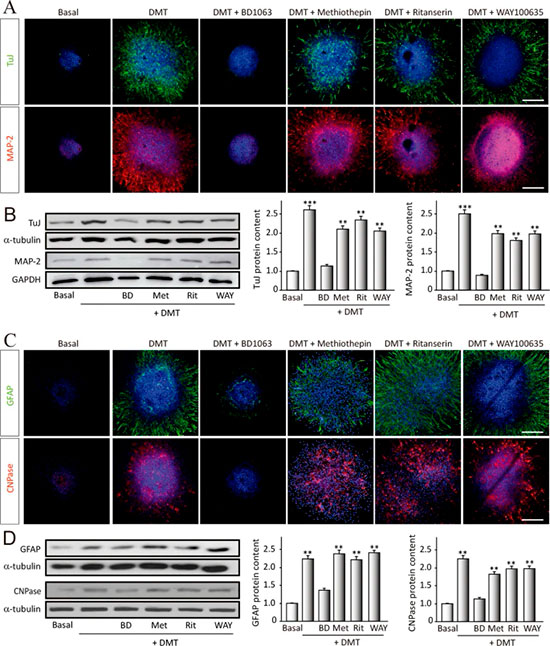
El N,N-dimetiltriptamina (DMT) promueve la diferenciación in vitro de NSC hacia los tres principales tipos celulares neurales
Para estudiar la capacidad de diferenciarse en un determinado fenotipo neuronal, utilizaron neuroesferas tratadas durante 7 días en presencia de DMT, sola o en combinación con los diferentes antagonistas, en condiciones de diferenciación (medio con 1% de suero bovino fetal y ausencia de factores de crecimiento). Analizaron la expresión de proteínas específicas vinculadas a cada subtipo neuronal, lo cual se muestra en la Figura 2. Para detectar neuronas, utilizaron β-III-tubulina (clon TuJ-1), que se encuentra exclusivamente en neuronas, y MAP-2 (proteína 2 asociada a microtúbulos), presente en neuronas maduras; y para estudiar su diferenciación hacia un fenotipo astroglial u oligodendroglial, analizaron la expresión de GFAP (proteína ácida fibrilar glial) (astrocitos) y CNPasa (oligodendrocitos).
La Figura 2a, b muestra un aumento sorprendente en la expresión de β-III-tubulina y MAP-2 en neuroesferas tratadas con DMT, en comparación con cultivos basales (no tratados). Este efecto neurogénico está claramente bloqueado por BD. No observaron diferencias en la expresión de marcadores neuronales cuando los cultivos se trataron con DMT en combinación con metiotepina, ritanserina o WAY. Estos resultados sugieren que el DMT estimula la diferenciación in vitro de progenitores neuronales hacia un fenotipo neuronal a través de S1R.
En relación con la gliogénesis, la Figura 2c, d muestra un aumento en los niveles de expresión de GFAP y CNPasa después del tratamiento con DMT. Esta promoción de la generación de células astrogliales y oligodendrocitos se bloqueó cuando los cultivos se pretrataron con el antagonista BD1063. No observaron diferencias en la expresión de GFAP y CNPasa cuando las neuroesferas fueron pretratadas con los otros antagonistas. Estos resultados pueden sugerir un efecto directo del DMT en la diferenciación in vitro de progenitores neuronales hacia astrocitos y oligodendrocitos a través de S1R.
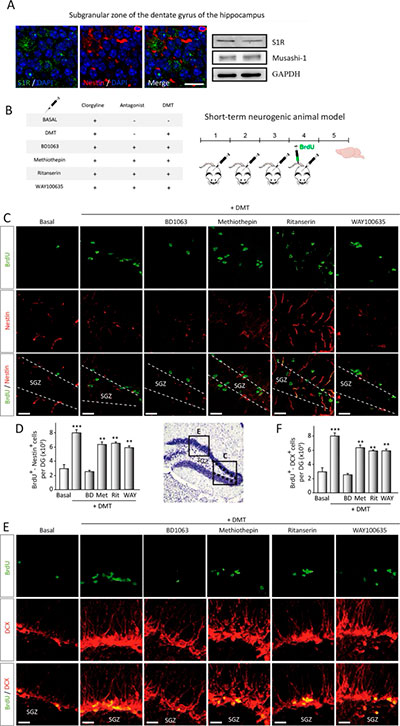
El DMT activa in vivo el nicho neurogénico de la zona subgranular en ratones adultos
Para confirmar los resultados in vitro sobre el papel de S1R en la acción neurogénica de DMT, primero determinamos la expresión de S1R en el nicho neurogénico subgranular. Para ello, analizaron secciones coronales de cerebro, incluido el hipocampo, y muestras de proteínas aisladas de la SGZ. Y como se puede observar en la Figura 3a, la inmunofluorescencia en la zona subgranular y el análisis de Western blot, muestran la expresión de S1R en esta área cerebral.
A continuación, analizaron si el DMT también ejercía un efecto estimulante de la cinética de proliferación de NSC en SGZ in vivo. Para ello, a ratones adultos les inyectaron por vía intraperitoneal durante 4 (corto plazo) o 21 días (largo plazo) DMT solo o en combinación con antagonistas, seguido de la administración de BrdU durante 24 h (Fig. 3) o 21 días (Fig. 4) antes del sacrificio. En animales a corto plazo (Fig. 3b), el análisis inmunohistoquímico y de recuento de células realizado en secciones coronales en serie de cerebro que contenían SGZ (Fig. 3c, d), demostró que el DMT aumentó significativamente el número de células teñidas con doble BrdU / Nestin en SGZ, en comparación con los valores de control (grupo tratado con clorgilina). Esta estimulación neurogénica parecía estar mediada por el S1R, ya que no observaron ningún efecto neurogénico cuando se administra DMT junto con el antagonista BD1063. Asimismo, no encontraron diferencias en la inmunotinción de BrdU y nestina en aquellos animales inyectados con DMT en combinación con el antagonista metiotepina y WAY100635.
Durante el proceso neurogénico, la proliferación es crucial, pero también la migración del precursor recién generado desde la SGZ a la capa granular. Para estudiar la migración de precursores neuronales, se tiñeron secciones de cerebro coronal en serie para doblecortina (DCX). Los resultados, que se muestran en la Figura 3e y3f, muestran más células BrdU/DCX inmunopositivas en la SGZ de animales tratados con DMT. Además, las células exhibieron extensas arborizaciones dendríticas. No observaron diferencias cuando los animales fueron tratados con DMT combinado con antagonistas. Por el contrario, cuando se inyectó DMT con BD1063, la expresión de Brdu o DCX no aumentó. Estos resultados confirman que los ratones tratados con N,N-dimetiltriptamina (DMT) exhiben una mayor proliferación y migración de precursores neurales en la SGZ después de 4 días de tratamiento, lo que sugiere un efecto modulador de este compuesto en la neurogénesis del hipocampo in vivo.
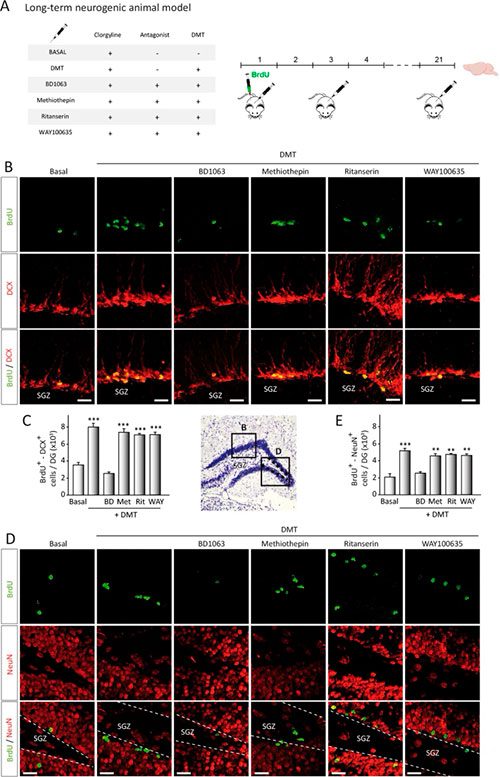
Para saber si estos nuevos neuroblastos migratorios podían alcanzar adecuadamente la capa de células granulares, se usaron animales tratados a largo plazo (21 días) (Fig. 4a). El análisis de cuantificación de las imágenes confocales demuestra un aumento en las células DCX+/BrdU+ en la SGZ después del tratamiento con DMT (Fig. 4b, c). No encontraron diferencias en aquellos animales tratados con DMT junto con metiotepina o WAY100635. Una vez más, el tratamiento combinado de DMT con BD1063 bloqueó el aumento de la migración observado en los animales tratados solo con DMT.
Además, cuando los neuroblastos alcanzaron la capa de células granulares, observaron un aumento notable en la cantidad de neuronas recién generadas (células BrdU+/NeuN+) en esta capa (Fig. 4d, e) en animales tratados con DMT. Este aumento se bloqueó cuando los ratones se trataron con DMT junto con BD1063. En conjunto, estas observaciones indican claramente que DMT aumenta in vivo el número de nuevas neuronas originadas en el hipocampo, acción mediada por S1R.
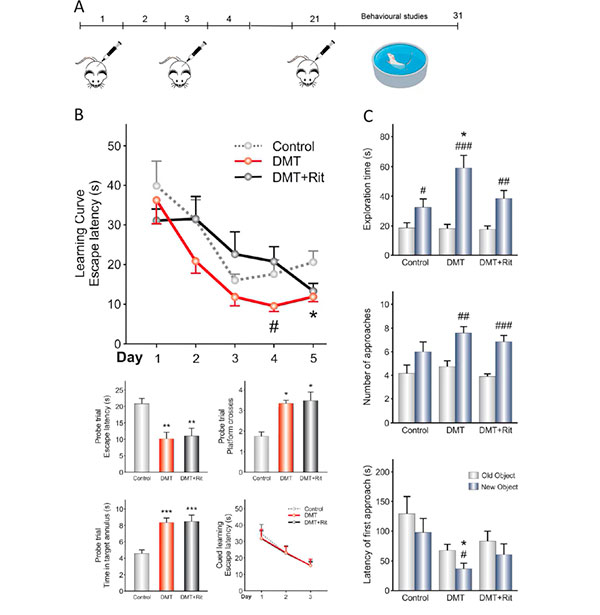
Teniendo en cuenta estos resultados, por último, analizaron las consecuencias funcionales del tratamiento con DMT mediante la realización de tareas conductuales (Fig. 5a), para analizar si la memoria y el aprendizaje se ven afectados. La Figura 5b (panel izquierdo) muestra los resultados obtenidos por la prueba del laberinto de agua de Morris. Aquí, durante la curva de aprendizaje, hubo diferencias significativas entre los grupos solo en los días 4 y 5, lo que demuestra que el grupo DMT tendió a reducir la latencia de escape en comparación con los grupos DMT + ritanserina y control.
En la prueba de ensayo, los grupos de DMT y DMT + ritanserina mostraron una reducción significativa en la latencia de escape en comparación con el grupo de control. Estos recordaron con mayor eficacia la zona donde se encontraba la plataforma de escape oculta. Durante los 3 días de aprendizaje guiado, no observaron diferencias entre los grupos, lo que indica que las diferencias observadas en la curva de aprendizaje y la prueba de ensayo, no se debieron a diferencias en la motivación de los animales para escapar del agua ni en las habilidades sensoriomotoras.
En cuanto a la prueba de reconocimiento de nuevos objetos (Fig. 5c, panel derecho), el grupo DMT mostró un mayor tiempo de exploración del nuevo objeto y un mayor número de acercamientos al mismo. Además, este grupo tendía a explorar el nuevo objeto antes que el anterior. El grupo de DMT + ritanserina pasó más tiempo explorando el nuevo objeto y se acercó a él más veces. Finalmente, el grupo de control solo gastó más tiempo explorando el nuevo objeto. Asimismo, obtuvieron diferencias en la latencia del primer abordaje y tiempo de exploración entre los grupos DMT y control. Estos resultados sugieren que los grupos de DMT y DMT + ritanserina mostraron una mejor memoria episódica en comparación con el grupo de control.
Discusión y Conclusión del estudio
La principal limitación de este trabajo fue que antes no se había descrito el papel potencial del N,N-dimetiltriptamina (DMT). Además, estudios previos realizados en roedores y primates, incluso en humanos, sugieren que la infusión de ayahuasca tiene actividad antidepresiva, un efecto terapéutico generalmente relacionado con la neurogénesis del hipocampo. Este trabajo amplía los resultados previos indicando el papel del DMT, uno de los principales compuestos de la infusión alucinógena ayahuasca, en la neurogénesis adulta.
Los resultados in vitro e in vivo de este estudio, demuestran que el DMT es un regulador clave en la actividad de los NSC adultos, ya que este compuesto juega un papel importante en la regulación de la expansión y diferenciación de la población de células madre ubicadas en la SGZ, uno de los principales nichos neurogénicos adultos. Esto se revela in vitro por un aumento en el número y tamaño de las neuroesferas primarias y una mayor expresión de ki67 y PCNA, lo que indica una alta tasa de proliferación y pérdida de “troncalidad” después del tratamiento con DMT.
El aumento de la proliferación no indica compromiso neuronal; sin embargo, el DMT también indujo un aumento en las células β-III-tubulina+ y MAP-2 +, lo que sugiere la promoción de la diferenciación hacia un fenotipo neuronal y el aumento del número total de neuronas que alcanzan la madurez neuronal.
Curiosamente, a diferencia de lo descrito anteriormente sobre la acción de las carbolinas in vitro, también han encontrado un aumento en el número de otras células neurales como astrocitos y oligodendrocitos tras el tratamiento con DMT.
Se observaron resultados similares in vivo, con una mayor tasa de proliferación de las NSC y una mayor población de neuroblastos que expresan doblecortina que migran a la capa granular del hipocampo para generar nuevas neuronas. Además, tienen un impacto funcional, ya que el tratamiento con DMT durante 21 días mejoró claramente el rendimiento de los ratones en tareas de aprendizaje y memoria, en las que se considera que el hipocampo juega un papel fundamental. Estas observaciones, están de acuerdo con trabajos previos que muestran que la neurogénesis del hipocampo adulto juega un papel importante en estas funciones cognitivas. Considerando estos efectos, se puede determinar que el N,N-dimetiltriptamina (DMT) tiene la capacidad de regular la expansión y el destino de las poblaciones de células madre y, por lo tanto, contribuir al procesamiento de la memoria y el aprendizaje.
La neurogénesis consiste en la proliferación y pérdida de “troncalidad” de las NSC, la migración de neuroblastos y la diferenciación en neuronas funcionales. Los resultados aquí obtenidos demuestran que el DMT controla todas estas etapas. Curiosamente, además del potencial neurogénico, el DMT también indujo la formación de astrocitos y oligodendrocitos. Esta capacidad de control de la neurogénesis es de gran interés, ya que en condiciones patológicas se debe optimizar la renovación de las neuronas actuando simultáneamente sobre varios procesos.
Uno de los objetivos de este trabajo es que, además de su efecto neurogénico, el DMT también estimule la migración y nueva generación de células astrogliales y oligodendrocitos, lo que destaca la versatilidad de este compuesto, ya que puede promover todos los procesos involucrados en la neurogénesis adulta completa. Específicamente, se sabe que los astrocitos respaldan la proliferación, supervivencia y maduración de neuronas y neuroblastos en desarrollo que ya se han comprometido con linajes neuronales, pero también promueven la neurogénesis. De hecho, trabajos previos demostraron que los astrocitos in vitro podrían convertirse directamente en neuronas o células de tipo troncal, lo que apunta a la plasticidad de estas células gliales somáticas. No se han descrito estudios previos sobre el efecto neurogénico del DMT, pero en comparación con el efecto de otros componentes de la ayahuasca, como las β-carbolinas, se puede concluir que el efecto del N,N-dimetiltriptamina (DMT) sobre la neurogénesis adulta es considerablemente más potente.
Como valor adicional a la generación de neuronas, la formación de células gliales inducida por DMT podría ser un objetivo ideal para la conversión neuronal in vivo después de una lesión neuronal, ya que algunos estudios han logrado generar neuroblastos proliferantes no tumorigénicos a partir de astrocitos residentes. La principal implicación terapéutica de los resultados aquí obtenidos se deriva de la estrecha relación entre neurogénesis y actividad antidepresiva descrita en varios modelos animales.
El DMT se considera un fármaco serotoninérgico porque su mecanismo de acción consiste en el agonismo sobre diferentes receptores serotoninérgicos, especialmente los receptores 5-HT2A, ampliamente descritos como inductores de la neurogénesis, pero también psicodélicos. Una de las principales limitaciones que surgen a la hora de diseñar un posible fármaco a partir de los resultados obtenidos, es conseguir el efecto neurogénico deseado sin provocar al paciente efectos alucinógenos secundarios.
Los resultados aquí obtenidos indican que los efectos observados del N,N-dimetiltriptamina (DMT) están mediados por la activación del S1R. En este sentido, se ha demostrado que la estimulación del S1R por diferentes agonistas potencia la neurogénesis en el hipocampo. Además, la evidencia in vivo sugiere que la deficiencia de σ1R interrumpe la neurogénesis adulta. En humanos, el uso de agonistas de S1R, como la fluvoxamina, muestra implicación en la neuroplasticidad, lo que sugiere un papel importante en la mejora del mecanismo de aprendizaje. En estudios clínicos, algunos agonistas de S1R, incluidos fluvoxamina, donepezilo y neuroesteroides, mejoran el deterioro cognitivo.
Recientemente, otro estudio previo ha descrito el papel de otra triptamina psicoactiva, la 5-metoxi-N,N-dimetiltriptamina (5-MeO-DMT), en la neurogénesis. A diferencia de la inyección intracerebral de 5-MeO-DMT administrada en ese otro estudio, aquí se administró el DMT intreperitonealmente, de modo que puede atravesar la barrera hematoencefálica, lo que facilita su futura administración en humanos. Además, el efecto neurogénico del DMT a través de la activación de S1R se combina con el antagonismo del receptor 5-HT2A, evitando los efectos alucinógenos de estos derivados de la triptamina. Esta información podría ser muy útil para el futuro desarrollo de nuevos tratamientos contra la neurodegeneración.
En conclusión, este estudio muestra que el N,N-dimetiltriptamina (DMT) presente en la infusión de ayahuasca, promueve la neurogénesis al estimular la expansión de las poblaciones de progenitores neuronales e inducir la diferenciación de estas NSC. Además, la estimulación neurogénica observada después del tratamiento con DMT, se correlaciona con una mejora en el aprendizaje espacial y tareas de memoria in vivo. La versatilidad y la completa capacidad neurogénica del DMT, garantizan futuras investigaciones sobre este compuesto. Además, su capacidad para modular la plasticidad cerebral indica su potencial terapéutico para una amplia gama de trastornos psiquiátricos y neurológicos, entre los que se encuentran las enfermedades neurodegenerativas.
Fuente de este artículo
Este artículo fue publicado originalmente en Nature, bajo la referencia: Morales-Garcia, J.A., Calleja-Conde, J., Lopez-Moreno, J.A. et al. N,N-dimethyltryptamine compound found in the hallucinogenic tea ayahuasca, regulates adult neurogenesis in vitro and in vivo. Transl Psychiatry 10, 331 (2020) https://doi.org/10.1038/s41398-020-01011-0; y el cual está disponible con acceso libre en la propia web de Nature.


