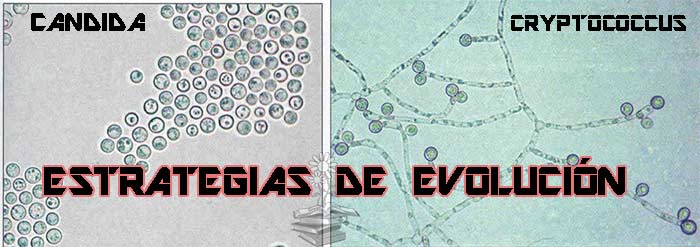
Históricamente, la investigación sobre patógenos fúngicos humanos ha quedado en segundo plano frente a otras enfermedades infecciosas, quizás debido a una percepción errónea común de que los hongos causan, en gran medida, infecciones superficiales. Sin embargo, los hongos pueden poner en peligro la vida de las personas inmunocomprometidas durante los procedimientos médicos o por afecciones como el VIH y la diabetes. Se estima que las infecciones fúngicas invasivas matan a más de 1 millón de personas cada año, con tasas de mortalidad que alcanzan el 50%. En este artículo científico, se explican las estrategias de evolución de patógenos fúngicos a corto plazo para adaptarse al hospedador (el hombre) y evitar los fármacos, lo cual es importante tener en cuenta de cara a la curación de estas infecciones.
Presentación
“Short-term evolution strategies for host adaptation and drug escape in human fungal pathogens” (“Estrategias de evolución a corto plazo para la adaptación del huésped y el escape de fármacos en patógenos fúngicos humanos”), es un artículo científico realizado por Chapman N. Beekman, Iuliana V. Ene publicado en mayo de 2020 en la revista Plos Pathogens, el cual resume con ejemplos las principales estrategias de evolución de patógenos fúngicos a corto plazo para adaptarse al hospedador hombre y evitar los fármacos.
En general, los desafíos para el tratamiento de infecciones fúngicas incluyen la disponibilidad limitada de antifúngicos y la capacidad innata de los hongos para evolucionar rápidamente y adaptarse a condiciones fluctuantes. Esta capacidad de adaptación, está parcialmente impulsada por una gran plasticidad genómica, con muchas especies adquiriendo diversos estados de ploidía, reordenamientos cromosómicos y mutaciones puntuales durante la colonización del hospedador. La plasticidad genética permite aumentos rápidos en la virulencia y la resistencia a los medicamentos antimicóticos, que, a menudo, se traducen en malos resultados de la enfermedad. Las estrategias de evolución a corto plazo (microevolución) en patógenos fúngicos, son, por lo tanto, esenciales para la adaptación ambiental en el huésped mamífero, y su estudio puede informar de los mecanismos de adaptación en otros eucariotas.
A continuación, se explica cada una de las principales estrategias de evolución de patógenos fúngicos a corto plazo para adaptarse a los hospedadores y librarse de los fármacos.
Los cambios de ploidía permiten saltos de fitness rápidos en condiciones estresantes
La ploidía se refiere al número de pares de cromosomas de las células. Por ejemplo, en el ser humano, las células somáticas que componen el cuerpo son diploides (con dos juegos completos de cromosomas, una serie derivada de cada uno de los padres), pero las células sexuales (óvulo y espermatozoides) son haploides.
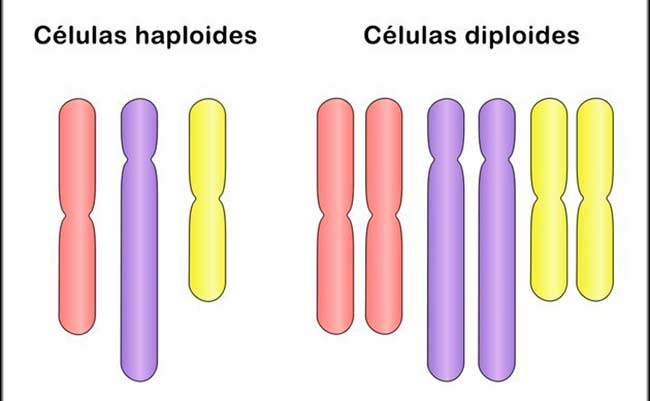
Muchos hongos clínicamente relevantes muestran cambios dinámicos en la ploidía, incluidas variaciones cariotípicas (número de conjuntos de cromosomas) y aneuploidía (desequilibrio en el número de copias de los cromosomas). Algunos patógenos fúngicos existen como células haploides, diploides o poliploides estables, pero la ploidía puede cambiar según las condiciones cambiantes. Se han descrito alteraciones en la ploidía inicial para algunos de los géneros más frecuentes (Candida, Cryptococcus y Aspergillus) y, a menudo, se seleccionan en el hospedador o durante el tratamiento antimicótico.
Bajo privación de nutrientes, los aislamientos de Candida albicans pueden favorecer estados casi haploides o casi diploides, lo que indica que la reducción del cariotipo puede proporcionar una ruta de adaptación eficiente en algunas condiciones. Asimismo, la aneuploidía también es común en los linajes de C. albicans y Cryptococcus neoformans y se ha relacionado con una mayor virulencia y resistencia a los medicamentos.
La duplicación cromosómica puede mediar en la adaptación a través de la dosificación de genes, ya que los niveles de transcripción suelen ser proporcionales al número de copias de genes. Esto se puede ver tanto en C. albicans como en las especies de Cryptococcus, para las cuales el tratamiento antimicótico selecciona el aumento de copias de cromosomas o segmentos cromosómicos que contienen objetivos farmacológicos y/o bombas de eflujo. De manera similar, en C. albicans, la formación de diferentes isocromosomas (duplicación parcial) permitió la resistencia a los azoles, mientras que la trisomía del cromosoma 2, confirió resistencia a la caspofungina. Así pues, estos estudios sugieren que las alteraciones de la ploidía son un mecanismo común que permite la adaptación al estrés repentino, incluido el tratamiento antifúngico.
Pérdida de heterocigosis como factor de variación fenotípica en especies diploides
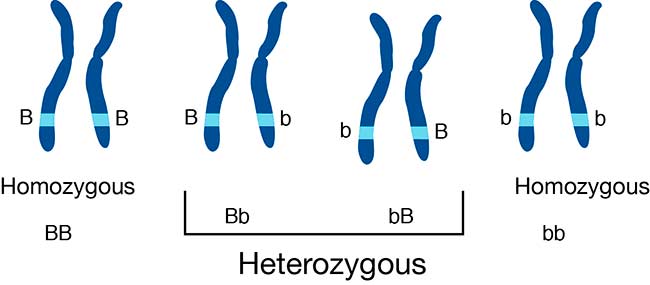
Otra estrategia de evolución de patógenos fúngicos a corto plazo que ha surgido como un mecanismo importante para la adaptación, es la pérdida de heterocigosidad (LOH) o la pérdida de información genética de un cromosoma homólogo.
La LOH puede surgir a través de roturas cromosómicas de doble cadena (seguidas de replicación inducida por rotura u otros mecanismos de reparación), así como a través de la recombinación entre regiones cromosómicas homólogas, que puede ocurrir tanto mitótica como meióticamente.
Mientras que los genomas diploides minimizan el impacto de la mutación de novo al mantener una copia ancestral de un alelo, LOH puede desenmascarar variantes recesivas en condiciones en las que otorgan un beneficio de aptitud. Esto es particularmente relevante para las especies diploides heterocigotas de Candida, pero también para los híbridos C. neoformans VNIII (AD).
Los eventos de LOH en regiones cortas a través de la conversión de genes o a través de la pérdida total o segmentaria de cromosomas, son comunes en los aislamientos clínicos de C. albicans y las cepas que se pasan en ratones. Los estudios de distribución de LOH encontraron la mayoría de los puntos de ruptura de LOH dentro o junto a secuencias repetidas, lo que sugiere que el ADN repetitivo puede promover la recombinación genética entre homólogos o dentro de ellos. Dichos eventos de recombinación, pueden conducir a mutaciones de novo posteriores a través de mecanismos de reparación de ADN propensos a errores, lo que aumenta aún más la capacidad de LOH para acelerar la evolución fúngica.
Un par de ejemplos recientes destacan cómo la LOH en alelos recesivos puede alterar tanto la virulencia como el comensalismo en C. albicans. Estos hallazgos demuestran cómo los eventos LOH pueden afectar significativamente las trayectorias evolutivas de C. albicans durante la colonización del huésped. Además, la LOH de alelos hemicigóticos de reguladores clave puede representar un mecanismo común por el cual C. albicans puede aumentar su aptitud en el hospedador.
Variación genética a pequeña escala con consecuencias en todo el genoma
Los cambios genómicos a gran escala, como la aneuploidía y los eventos de LOH, pueden afectar desde cientos a miles de genes en un solo ciclo celular, pero también conllevan un riesgo perjudicial significativo. Por lo tanto, no sorprende que la mayoría de los eventos mutacionales observados durante la microevolución fúngica estén representados por mutaciones a pequeña escala, incluidos SNP, inserciones y deleciones (indels) y LOH de tracto corto.
Estas pequeñas variantes también pueden tener amplias consecuencias posteriores cuando afectan genes críticos. Un ejemplo son las mutaciones en los factores de transcripción centrales, en los que una sola mutación puede alterar la expresión de cientos de genes. En C. neoformans VNI, el linaje de laboratorio de uso común H99 contiene una deleción en el regulador transcripcional Sgf29 que codifica una histona acetilasa. Varios aislamientos clínicos evolucionaron de forma independiente con mutaciones de pérdida de función en el gen SGF29, cuya inactivación afectó la acetilación en más de 700 loci y condujo a un fenotipo hipervirulento.
Las mutaciones dentro de los genes de reparación del ADN también pueden afectar las trayectorias de la evolución. Se han informado mutaciones en el gen de reparación de desajustes MSH2 en Candida glabrata y C. neoformans VNI, donde producen un fenotipo hipermutador. En ambas especies, la interrupción de los mecanismos de reparación de desajustes, permitió el desarrollo de resistencia a los medicamentos, lo que demuestra cómo las tasas de mutación aceleradas pueden permitir una adaptación rápida.
Escape del tratamiento antimicótico
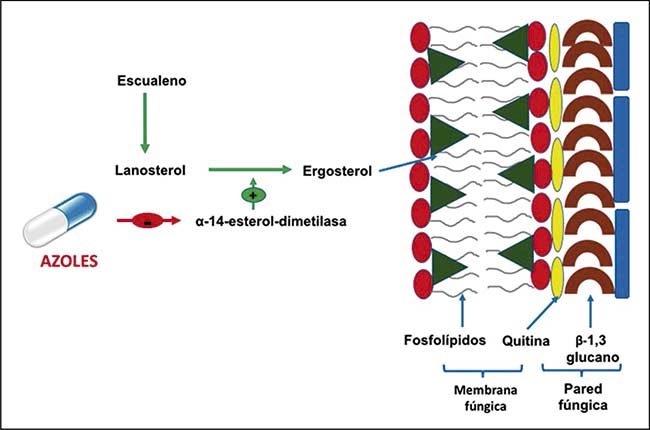
La capacidad de los patógenos fúngicos para desarrollar resistencia dentro del marco de tiempo de una sola infección puede poner en peligro la vida. El desarrollo de resistencia antifúngica es común durante las infecciones humanas por los principales patógenos: C. albicans, A. fumigatus y especies de Cryptococcus.
La evolución experimental utilizando diferentes tratamientos antimicóticos in vitro ha demostrado aún más la capacidad de los patógenos fúngicos para adquirir rápidamente resistencia a los medicamentos. Algunos estudios indican que la adquisición de resistencia al fármaco puede tener un costo de aptitud in vitro, ya que la resistencia, a menudo, se pierde durante el paso posterior en ausencia del fármaco. Sin embargo, el impacto de la resistencia a los medicamentos en el hospedador es más complejo, ya que pueden surgir aislamientos resistentes en pacientes incluso sin tratamiento antimicótico a través de mutaciones que brindan protección contra compuestos químicamente similares. Esto se ve en los aislados de pulmón de Candida lusitaniae, para los cuales, las mutaciones en el gen del factor de transcripción MRR1 confieren resistencia a los azoles y también contribuyen a la resistencia contra el péptido antimicrobiano del hospedador histatina 5 y las fenacinas bacterianas.
Los tipos de mutaciones genéticas que subyacen a la resistencia antifúngica son diversos entre especies y fármacos. Así pues, tanto Candida como Cryptococcus utilizan aneuploidía y aumentos asociados en la expresión génica de objetivos antifúngicos y bombas de expulsión para escapar del tratamiento farmacológico. LOH puede contribuir aún más a este proceso al permitir la homocigosis de los alelos mutados, y las mutaciones puntuales dentro de los propios genes diana del fármaco, también pueden impulsar la resistencia en las especies de Candida. En Aspergillus, mutaciones en CYP51 reducen la afinidad entre el azol y el objetivo del fármaco, lo que conduce a la resistencia al fármaco.
Y además de proporcionar una fuerte presión selectiva, la exposición a los antifúngicos puede por sí misma promover la variación genética. Esto se ve en C. albicans, en el que el tratamiento antimicótico da como resultado una mayor inestabilidad del genoma y frecuencias más altas de LOH y mutaciones puntuales. Por lo tanto, los antifúngicos impulsan la microevolución fúngica aumentando las tasas de variación genética y seleccionando aislados tolerantes y/o resistentes.
Microevolución en entornos complejos del hospedador
En contraste con los entornos definidos en los que se pasan los hongos en el laboratorio, las presiones selectivas que se encuentran en el hospedador son complejas y multifacéticas. Aquí, los hongos comensales y patógenos deben lidiar con la vigilancia inmunitaria constante, el pH fluctuante y la disponibilidad de nutrientes, además de competir con los microbios residentes. Este conjunto de presiones selectivas, da como resultado una gama más amplia de variabilidad genética que la que normalmente se observa después del paso in vitro. De hecho, para C. albicans, se estimó que ocurría un mayor número de mutaciones y tasas de recombinación durante el paso en el hospedador (infección del torrente sanguíneo y colonización del tracto GI) en relación con el crecimiento en medios de laboratorio ricos. Así, en C. albicans en ratones se vieron mutaciones frecuentes en los genes de adhesina de la pared celular, en relación con otras regiones codificantes, quizás debido a la gran cantidad de repeticiones en tándem que llevan estos genes. El paso de una cepa de C. albicans bloqueada por levadura dentro de los macrófagos murinos condujo a la restauración de la filamentación y la virulencia a través de un solo cambio de nucleótido en el componente mediador SSN3, lo que ilustra que las redes reguladoras complejas pueden reconfigurarse fácilmente a través de la microevolución. Estos estudios indican que el sistema inmunológico del hospedador es un impulsor clave de la microevolución y que la superficie de la pared celular es probablemente un sitio importante de variación genética.
Por otro lado, además de la inmunidad del hospedador, los microbios residentes en él también ejercen una presión sustancial sobre los patógenos fúngicos. De hecho, el paso GI de C. albicans en ratones neonatales inmunodeficientes y tratados con antibióticos, mostró que la adaptación a este nicho dependía de la inhibición de la microbiota, lo que sugiere que los microbios del hospedador limitan la adaptación de esta especie comensal al GI del ratón.
Las presiones metabólicas dentro del hospedador también pueden impulsar las estrategias de evolución de patógenos fúngicos a corto plazo. En C. neoformans VNI, el paso en serie a través del cerebro del ratón resultó en un mutante con una mayor expresión de una reductasa de hierro. La inmunidad nutricional mediada por el hospedador de micronutrientes como el hierro y el zinc, es, probablemente, una presión selectiva importante en diversos entornos del hospedador. Asimismo, el metabolismo oxidativo también puede estar bajo una fuerte selección dentro del hospedador. En un ejemplo, el paso de C. albicans a través de un modelo de infección sistémica, produjo una cepa deficiente en respiración, que era resistente a la fagocitosis y proliferaba en el hospedador con morbilidad reducida. Y en A. fumigatus, la aptitud física con poco oxígeno se asoció con una mayor virulencia en un modelo murino de infección pulmonar. Investigaciones posteriores revelaron que la adaptación a niveles bajos de oxígeno en esta especie dio lugar a alteraciones en la morfología del crecimiento, la arquitectura de la pared celular y la adhesión de las hifas, lo que a su vez aumentó la virulencia a través de la inflamación inmunopatológica. Estos estudios ilustran la complejidad de la microevolución fúngica en el entorno del hospedador, demostrando cómo se pueden vincular procesos aparentemente no relacionados, como la adaptación metabólica y la evasión inmune.
Equilibrar la variación genética nueva, la integridad del genoma y las compensaciones de fitness
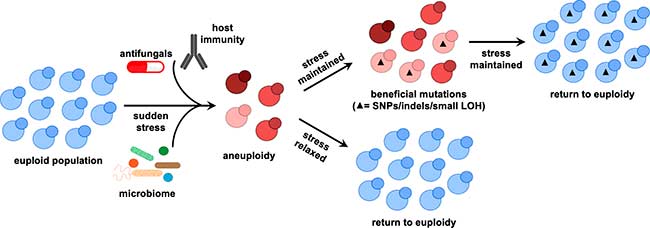
Los patógenos fúngicos humanos utilizan una amplia gama de estrategias para generar diversidad genética y adaptarse a entornos fluctuantes. Esta flexibilidad genómica permite una rápida adaptación a los fármacos antimicóticos o presiones selectivas dentro del hospedador. Si bien la capacidad de los hongos para tolerar una plasticidad genómica significativa proporciona una mayor adaptabilidad, esto plantea la cuestión de cómo esta capacidad se equilibra con la necesidad de mantener la integridad del genoma. Este requisito se puede relajar en nichos de hospedadores con plazos limitados debido a la muerte rápida del hospedador o aquellos que no facilitan la transmisión de patógenos (p. ej., infecciones profundas). Sin embargo, la integridad del genoma es crucial para la viabilidad fúngica en nichos de acogida con colonización sostenida, como la piel, los pulmones, los tractos genitourinario y GI.
Además, la necesidad de mantener la integridad del genoma se vuelve aún más apremiante cuando se considera que la aneuploidía y la LOH están asociadas con un aumento global de la inestabilidad del genoma. Para mitigar estos costos de aptitud, los hongos pueden emplear reordenamientos cromosómicos solo como una solución temporal al estrés repentino, «ganando tiempo» para adquirir mutaciones menos costosas como SNP e indels, tal y como puede verse en la representación de la imagen superior, donde las celdas de color rojo representan células con diferentes niveles de ploidía y los triángulos negros representan mutaciones beneficiosas.
Sin embargo, cómo estas especies equilibran la plasticidad genómica con la integridad genómica, sigue siendo un gran vacío en nuestra comprensión de los patógenos fúngicos, lo cual se ve en nuestra incapacidad para tratar eficazmente las infecciones fúngicas invasivas, un desafío importante dado el repertorio limitado de antifúngicos disponibles.
Por otra parte, también es fundamental una mejor comprensión de la relación entre comensalismo y virulencia. Dada la diversidad de nichos de acogida que pueden ocupar los hongos, la microevolución puede inclinar rápidamente la balanza entre el comensalismo y la patogénesis. Esto se demuestra en C. albicans en donde las cepas adaptadas al tracto GI u orofaríngeo del ratón perdieron la capacidad de causar una infección sistémica letal, mientras que los aislamientos recuperados de los riñones durante una infección sistémica en serie muestran una destrucción acelerada del hospedador.
Comprender las presiones selectivas dentro de nichos de hospedantes específicos y cómo los genomas fúngicos responden a ellas durante la microevolución, es fundamental para definir los mecanismos por los cuales los hongos se adaptan y evolucionan, particularmente en el contexto de la infección del hospedador en mamíferos.
Fuente de este artículo
Este artículo fue publicado originalmente en la revista “Plos Pathogens” bajo la referencia: Beekman CN, Ene IV (2020) Short-term evolution strategies for host adaptation and drug escape in human fungal pathogens. PLoS Pathog 16(5): e1008519. https://doi.org/10.1371/journal.ppat.1008519; estando disponible con acceso libre en la web de la misma Plos Pathogens.


